 Los alcoholes tienen de formula general: R-OH, estructuralmente son semejantes al agua, en donde uno de los hidrógenos se ha sustituido por un grupo alquilo. Su grupo funcional es el grupo hidroxilo, OH.
Los alcoholes tienen de formula general: R-OH, estructuralmente son semejantes al agua, en donde uno de los hidrógenos se ha sustituido por un grupo alquilo. Su grupo funcional es el grupo hidroxilo, OH.Los fenoles tienen el mismo grupo funcional, pero unido a un anillo aromático (Ar –OH).
Los éteres tienen de formula general R - O - R', donde R y R' pueden ser grupos idénticos o diferentes y pueden ser grupos alquilo o arilo.
Nomenclatura de Alcoholes. Los alcoholes, al igual que los halogenuros de alquilo, se clasifican o dividen en primarios, secundarios y terciarios, según el número de grupos hidrocarbonados unidos al átomo de carbono al que va enlazado el grupo hidroxilo.
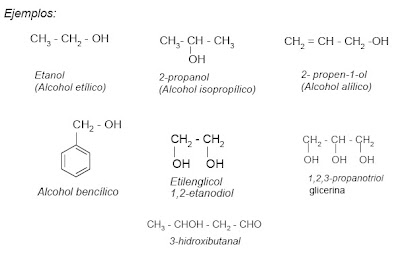
En la nomenclatura de alcoholes se suelen emplear nombres vulgares para los términos más sencillos ( C1 - C4 ). Estos nombres se forman con la palabra alcohol.
El sistema IUPAC nombra a los alcoholes de acuerdo a las siguientes reglas:
1. Se busca la cadena más larga que incluya el grupo hidroxilo. La terminación o del hidrocarburo se cambia por -ol.
2. La cadena se numera de forma que al grupo funcional le corresponda el menor número posible. Si hay más de un grupo hidroxilo en la cadena, se emplean los prefijos di, tri, etc.
3. Cuando el alcohol no es el grupo funcional principal se nombra como hidroxi, precedido de su número localizador.
Nomenclatura de fenoles. Para nombrar los fenoles se utiliza, como en los alcoholes el sufijo -ol al nombre del hidrocarburo aromático. Los fenoles se nombran con mayor frecuencia como derivados del fenol. Los otros sustituyentes del anillo se localizan con un número o mediante los prefijos orto, meta, para.
El grupo hidroxilo también se nombra como sustituyente cuando se encuentra presente en la misma molécula un ácido carboxílico, un aldehido o alguna cetona, ya que tienen prioridad en la nomenclatura.
Nomenclatura de Eteres: Los éteres se denominan generalmente con el nombre de cada uno de los grupos alquilo o arilo, en orden alfabético, seguidos de la palabra eter.
En el caso de éteres con estructuras más complejas, se nombra según la IUPAC considerando que uno de los radicales (el mayor si se trata de un éter asimétrico) es un hidrocarburo que lleva como sustituyente el grupo alquilo pequeño con el oxigeno, al que se denomina grupo alcoxi.














.jpg)









